衛研ニュース カンピロバクター下痢症(食中毒)
広島市の散発下痢症患者から分離されたCampylobacter jejuniの血清型別・薬剤耐性について
カンピロバクターは、ニワトリ、ウシなどの家畜、ペット、野鳥野生動物などの腸管内に広く生息しています。
古くから、カンピロバクターは、牛や羊などの家畜の流産の原因菌であることが知られていましたが、1970年代に人からの分離に成功し、人の下痢症の原因となることが報告されました。
その後、それまで原因がわからず、不明となっていた下痢症や食中毒の多くが、この菌によって引き起こされていることが、世界的に認められました。
この結果、わが国でも、1982年に厚生労働省から食中毒菌としてCampylobacter jejuniとCampylobacter coliが追加されました。
さらに、本菌を原因とした下痢症後に、ギランバレー症候群などの神経疾患を続発することがあることが知られています。
カンピロバクターの特徴
カンピロバクター属菌は17菌種(2007年現在)が知られています。人の下痢症(食中毒)の原因として重要な菌種はCampylobacter jejuniとCampylobacter coliですが、下痢症(食中毒)患者から検出されるカンピロバクターの90%以上はCampylobacter jejuniです。
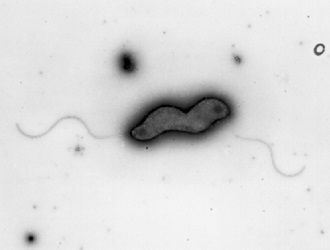
この菌は、顕微鏡でみると、ワインの栓を抜くコルクスクリューのような「らせん状」の形をしています(図1)。クルクルと回転する独特の動きをします。
他の食中毒菌と大きく異なる特徴は、5%~15%の低い酸素濃度の環境でしか増えることができないことです。このような性質をもった菌を「微好気性」菌といいます。
またこの菌は、熱や乾燥に弱く、死滅しやすい、一見すると弱い菌なのですが、適した環境下では生存し、少量で下痢症(食中毒)を起こします。
カンピロバクター食中毒の発生状況
カンピロバクターによる食中毒は、前述のようにCampylobacter属菌のうち、その大半はCampylobacter jejuniによって起きています。
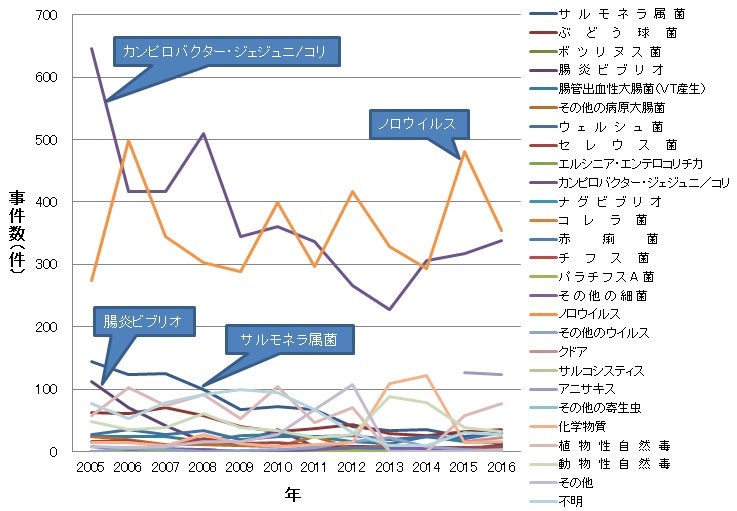
カンピロバクターによる食中毒は、全国的にノロウイルスによる食中毒と毎年1・2位を争う発生事例数の多い食中毒です。しかし、ノロウイルスと異なり、1事例当たりの患者数が少ない事例が多いのが特徴です。
カンピロバクター、ノロウイルス以外の微生物を原因とする食中毒の年間発生事例数が、近年100事例を下回る中(サルモネラ属菌:2008年以降、腸炎ビブリオ:2006年以降)(図2)、カンピロバクターによる食中毒の発生防止は、ノロウイルスによるものと並んで優先度の高い食品安全課題となっていることから、現在、その微生物学的なリスク分析やそれに基づく予防対策の検討が内外で進められています。
広島市においては、1997年より患者数一人の食中毒事例、いわゆる散発事例の届出が多くなされるようになり、それらは保健所から厚生労働省に報告され、各年の食中毒統計に計上されています。現在も、カンピロバクター食中毒は広島市で最も届出数の多い食中毒となっています。
(厚生労働省統計資料より作成)
参考
-
食中毒事件一覧速報(厚生労働省)(全国での食中毒発生状況について)(外部リンク)

-
広島市食中毒発生状況まとめ(令和2年~令和6年)
(食品保健課)(広島市での食中毒発生状況について) -
カンピロバクター
(食品保健課)(カンピロバクターによる食中毒について)
カンピロバクターの血清型別法
カンピロバクター腸炎(食中毒)の発生状況をより細かく見るための微生物学的な検査としては血清型別があります。
カンピロバクターの「血清型」を決める方法には、国際的には、大きくわけて2種類の方法が認められています。両法とも、カナダの研究者が最初に開発し、発展させたもので、その名前をとってリオール(Lior)法、ペナー(Penner)法と呼ばれている方法です。
「血清型」とは、菌の表面にあるべん毛や他の構造物など、タンパク質や糖類、脂質などから造られた構造物(免疫学では「抗原」といいます)の違いを、複数種の特異的な免疫抗血清(免疫学の分野では「抗体」といいます)を用いて検査し、該当した抗血清の種類によって決定された「型」のことをいいます。
リオール法
菌が運動し移動するために、ボートを漕ぐオールのような役目をしているべん毛などの、熱に弱い構造物(易熱性抗原といいます)の違いを区別する方法です。
型別に関係する易熱性抗原は、先に述べたべん毛や菌体の表面にある多糖体抗原などの複合的な菌体表層抗原であろうと考えられています。鞭毛抗原などを含む多糖体抗原などの複合的菌体表層抗原である易熱性抗原を標的としたスライド凝集法により型別する方法です。
型別率は低くはありませんが、検査のための市販品はありません。
ペナー法
リオール法とは対照的で、熱に強い耐熱性抗原の違いを区別する血清型別法です。この耐熱性抗原の主体は、やはり菌の表面にあるリポオリゴサッカライド(LOS)、または莢膜ポリサッカライドなどの耐熱性の多糖類と考えられています。リポオリゴサッカライドを主体とする耐熱性抗原を標的とした受身血球凝集法(PHA法)により型別する方法です。
ペナー法には検査のための市販品があり、どこの施設でも実施することができます。しかしながら、手技が煩雑であり、1件当たりのコストが高く、型別率も低いという欠点もあります。
PCR法によるペナー型別
近年、莢膜多糖合成遺伝子をPCR法により型別することでペナー遺伝子型を決める方法(Penner遺伝子型別法)が報告され、各地の衛生研究所等で検討・導入されつつあります。
現在当所では、ペナー法の型別率を上げるために、PHA法での型別不能株及び凝集の弱かった株についてPCR法により一部のペナー群の型別検査を実施しています。PHA法とPCR法を組み合わせることで、PHA法で型別不能等であった株の約78%が型別できました(H27年度実施検査結果)。
現在では、全てのPenner群を検出可能なPCR法も報告されており、この方法を導入することで型別率は更に高くなると考えられます。
| 血清群 | 抗原因子 |
|---|---|
| A群 | HS1、HS44 |
| B群 | HS2 |
| C群 | HS3 |
| D群 | HS4A、HS4B |
| F群 | HS6 |
| G群/HS17 | HS8/17 |
| L/U群 | HS15/31 |
| I群 | HS10 |
| R群 | HS53、HS23/36 |
| Z2群 | HS41 |
Campylobacter jejuniの血清型(広島市)
ペナー血清型別
散発下痢症患者由来のCampylobacter jejuniのペナー型別結果を図3に示しました。
8年間全体では、分離頻度の高い血清群は(1)B群(32.9%)、(2)D群(8.7%)、(3)O群(6.1%)、(4)L群(3.6%)、(5)Y群(3.1%)、(6)C群(2.8%)でした。
PHA法のみを行った2009年~2014年では、全体での型別率は59.3%と低い型別率でした。
PHA法とPCR法を組み合わせて型別を行った2015年は82.4%と高い型別率でした。しかし、同様の型別法を行った2016年は64.0%の型別率で前年度ほどの高い型別率とはなりませんでした。更に型別率を上げるためには、PCRで型別可能な血清群を増やしていくことが必要です。
このような血清型別の検査結果を蓄積していくことで、その発生動向を把握することができます。また、集団食中毒や集団下痢症の発生の際の疫学的調査において、血清型は有用な検査情報となります。
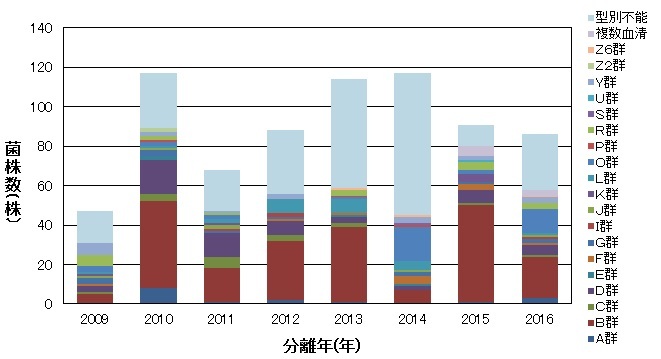
※2009年~2014年:PHA法、2015年~2016年:PHA法+PCR法
Campylobacter jejuniの薬剤耐性(広島市)
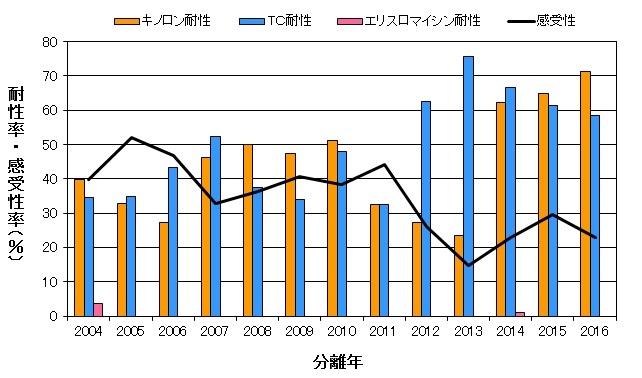
当所では、ノルフロキサシン(NFLX)、オフロキサシン(OFLX)、シプロフロキサシン(CPFX)、ナリジクス酸(NA)、テトラサイクリン(TC)、エリスロマイシン(EM)の6薬剤について、Sensi-Disc(BC)を用いた1濃度ディスク法により薬剤感受性を実施しています。その結果を図4に示しました。
TC耐性率は、2012年~2016年のここ5年、50%を越えています。
キノロン系薬剤に対しては、NFLX、OFLX、CPFX、NAの全てに耐性を示す耐性率が、2010年(51.3%)~2013年(23.5%)にかけては順次減少傾向がみられていましたが、2014年は62.4%、2015年は64.8%、2016年は71.3%と、ここ3年は高い耐性率を示しました。
マクロライド系薬剤のEMについては、2004年に3.6%の耐性率(7株)でしたが、以後2005~2013年まで耐性菌の分離はみられませんでした。2014年に1株(0.9%)の耐性株が分離されました。2004年の耐性株は、EM単独耐性2株、EM・TC耐性5株でしたが、2014年の耐性株は6薬剤すべてに耐性を示しました。
このページに関するお問い合わせ
健康福祉局衛生研究所 生物科学部
〒733-8650 広島市西区商工センター四丁目1番2号
電話:082-277-6998(生物科学部) ファクス:082-277-0410
[email protected]
